精神药物临床研究中,安全性评价是重要的组成部分。中国精神药物临床试验协作网及上海市药学会药物临床研究专业委员会推出《精神药物安全性评价的实践共识》,希望系统化解决安全性评价的差异问题,提高临床研究质量,并促进研究结果的互相印证与比较。以下简要介绍部分内容,更多信息请查阅共识全文。
表1 精神药物引起各系统常见不良事件或需要关注的严重不良事件
共识指出,精神药物所致「特别关注的不良事件」(AESI)部分为具体的实验室检测值或评估值。针对检查异常值的判断,基于临床经验,结合相关文献和国内外指南,提出以下具体的判断建议:
血清催乳素(PRL)升高
高催乳素血症(hyperprolactinemia)系指各种原因引起血清PRL水平持续显著高于正常值,并出现以性腺功能减退、泌乳或不育为主要临床表现的综合征。鉴于临床研究的实践以及文献的综合考虑,建议参考表2对PRL异常做相应判断。
表2 血清催乳素(PRL)异常值判断*

* :不同的实验室使用的催乳素单位可能不同,1 ng·mL-1=21.2 mIU·L-1
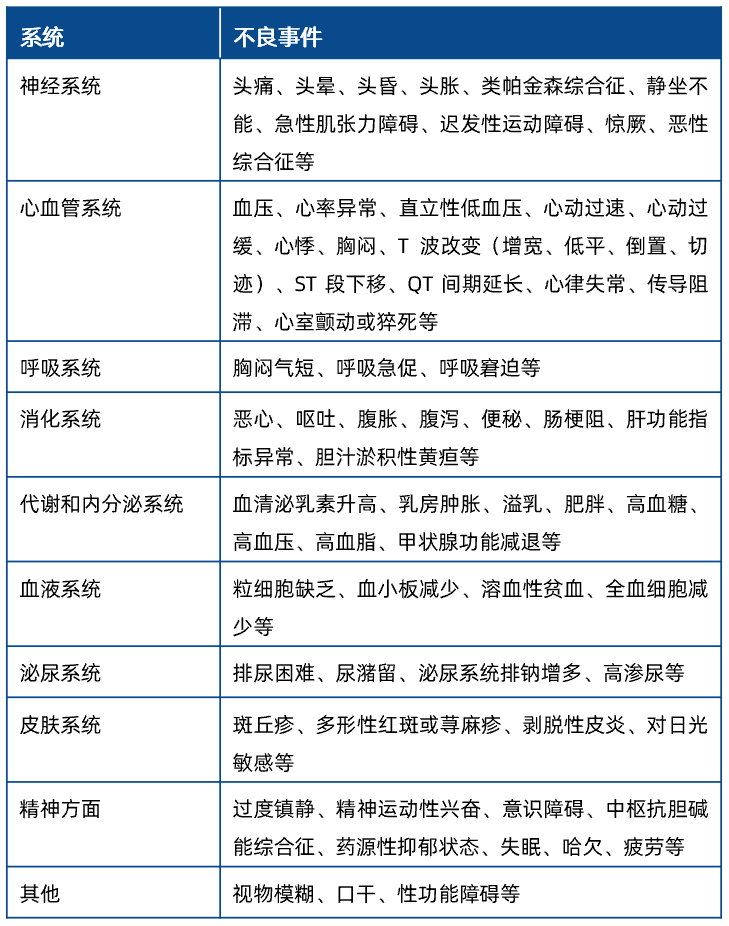
QTc 异常
中华医学会2010年防治建议指出,中国人QTc值尚无统一的标准,传统的观点及现用的标准将440 ms作为延长的界值,但是仍有10%~20%的正常人超过此标准。综合国内外的判断标准,建议参照表3对QTc异常做相应判断:
表3 建议报不良事件的QTc 异常值判断
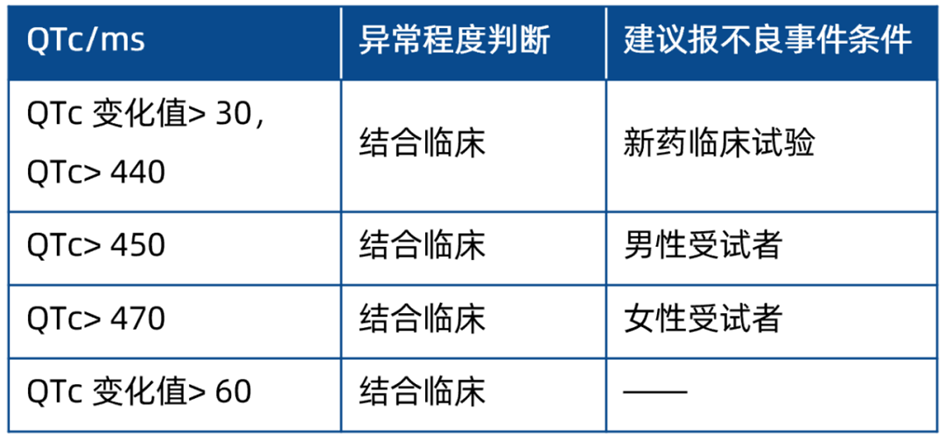
代谢综合征
2017 年中国 2 型糖尿病防治指南对代谢综合征进行了新定义,该标准不仅与国际指南的标准接轨,同时也更加符合中国人的诊断标准。对于满足诊断标准的患者,建议参照表4做出有临床意义的判断,并将代谢综合征作为不良事件的名称。
表4 建议报不良事件的代谢综合征判断
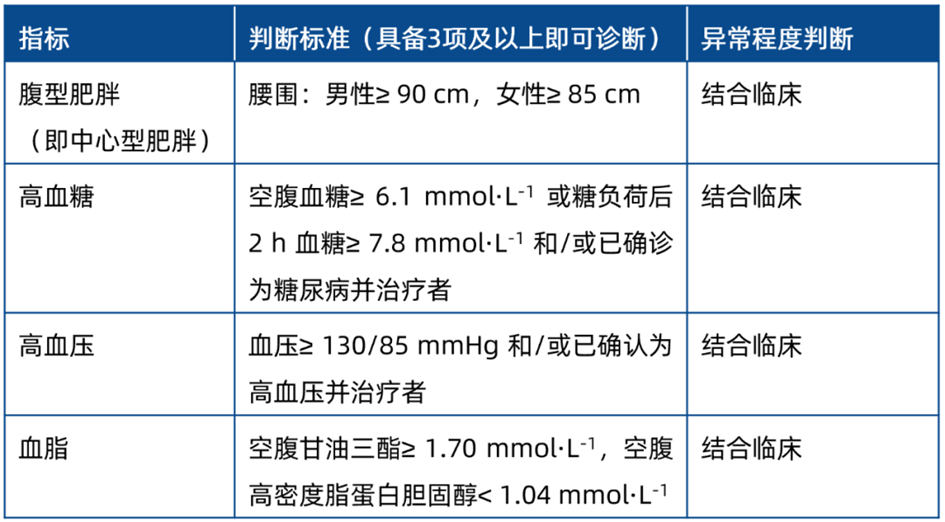
药物性肝损伤
目前国际上通常将急性药物性肝损伤的严重程度分为5级,结合我国肝衰竭指南,分级如下:0 级(无肝损伤),患者对暴露药物可耐受,无肝毒性反应;1 级(轻度肝损伤),多数患者可适应,可有或无乏力、虚弱、恶心、厌食、右上腹痛、黄疸、瘙痒、皮疹或体重减轻等症状;2 级(中度肝损伤),上述症状可有加重;3 级(重度肝损伤),患者症状进一步加重,需要住院治疗,或延长住院时间;4 级(急性肝衰竭),可同时出现:(1)腹水或肝性脑病,(2)与药物性肝损伤相关的其他器官功能衰竭。建议参照表5对药物性肝损伤做相应判断。
海氏法则(Hy’s law)有助于评估严重肝功能损害,在新海氏法则中,将新R值纳入考量,具体定义:(1)丙氨酸转氨酶(ALT) 或天冬氨酸转氨酶(AST)(以高者计)升高至正常值上限3 倍以上,同时血清总胆红素(TBil)升高至大于2 倍正常值上限;(2)新R值即ALT 或AST(以高者计)正常值上限倍数/ 碱性磷酸酶(ALP) 正常值上限倍数≥ 5 ;(3)无其他原因可以解释 ALT 和 AST 与 TBil 的同时升高,如甲、戊、乙或丙型病毒性肝炎,既往存在的或正在发生的其他急性肝病,或同时应用了能引起肝损伤的其他药物,并能排除肌源性 AST 升高。在临床试验中建议参照此标准,及时识别严重的肝损伤并予相应处理。
表5 建议报不良事件的药物性肝损伤判断
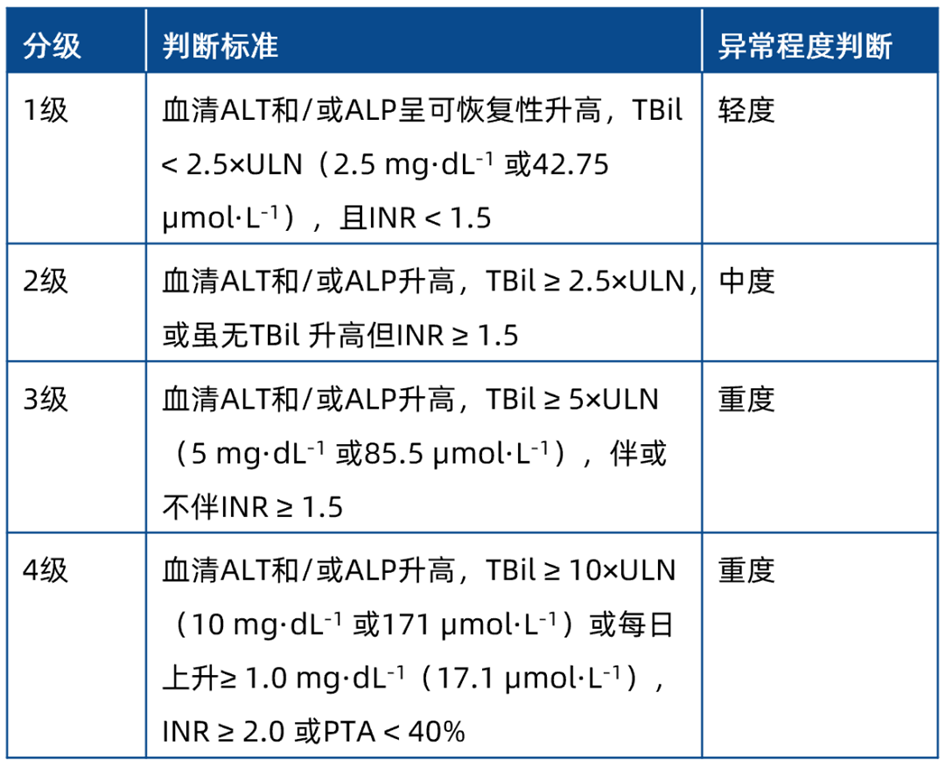
ALT :丙氨酸转氨酶,ALP :碱性磷酸酶,TBil :总胆红素,ULN :正常值上限,INR :凝血酶原时间国际标准化比值,PTA :凝血酶原活动度
锥体外系不良反应
锥体外系不良反应量表评分达到如下标准时,建议考虑判定相应的AE,见表6。
表6 建议报不良事件的锥体外系不良反应判断
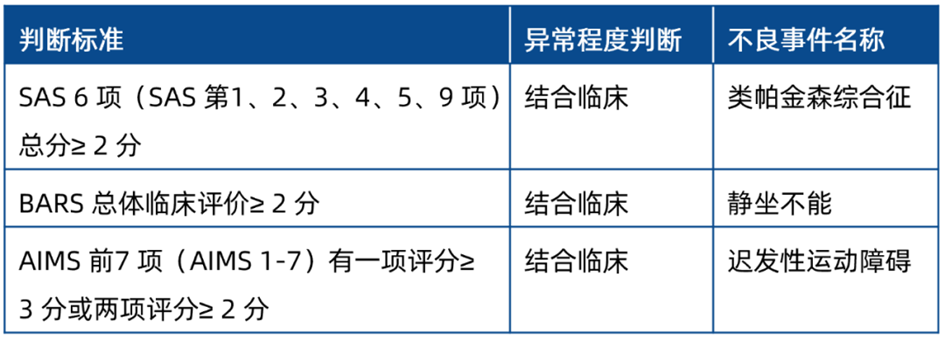
SAS :辛普森-安格斯量表,BARS :巴恩斯静坐不能量表,AIMS :异常不自主运动量表
药物的临床依赖性
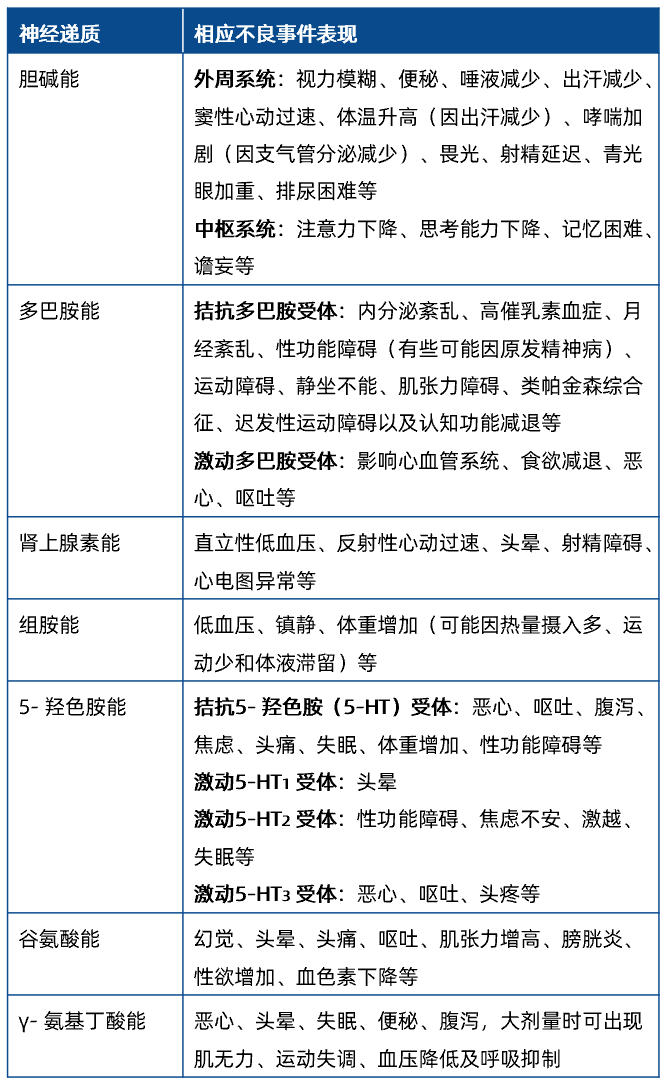
对于具有滥用潜力的创新药和改良型新药需要重视药物的临床依赖性。已知可能与滥用潜力相关的中枢神经系统靶点包括:阿片类、多巴胺、5- 羟色胺、大麻素、γ- 氨基丁酸、N- 甲基-D- 天门冬氨酸受体,以及转运体(如多巴胺、5- 羟色胺、γ- 氨基丁酸)和离子通道复合物(如钙、钾、氯)等。
评估药物临床依赖性时,通常需要收集滥用相关AE,对心率、血压、瞳孔大小、呼吸节律、氧饱和度等与中枢神经效应关系更为密切的生理指标变化的观察非常重要;进行认知和行为测试;评估躯体依赖性(戒断反应),包括头痛、焦虑、恶心、呕吐、震颤、注意力下降、烦躁、易怒、睡眠障碍等。人类滥用潜力(human abuse potential)研究必须在住院环境中进行,研究设计通常包括筛选期、导入期、给药期和随访期(包括洗脱期),评估指标包括主观效应量表评分、药动学数据、生理指标以及与滥用相关的AE。
表7 不同神经递质通路相关的常见不良事件或需要关注的严重不良事件
来源:精神药物安全性评价的实践共识[J].中国新药与临床杂志,2023,42(12):769-773.














